Ведущие отечественные научные организации, включая Московский государственный университет имени М.В. Ломоносова, Институт биоорганической химии имени академиков М.М. Шемякина и Ю.А. Овчинникова РАН и ряд других, объединили усилия для создания уникального противоопухолевого препарата с одновременным двойным действием. Разработка получила грантовую поддержку Российского научного фонда (РНФ) и была высоко оценена научным сообществом. Основным научным координатором проекта выступила Анна Яголович, внесшая значительный вклад в успех исследования.
Передовой подход к комбинированной терапии
Основная идея этого инновационного средства заключается в одновременной атаке на опухолевые клетки и кровеносные сосуды, обеспечивающие рост новообразования. Обычно стандартная терапия блокирует ангиогенез — процесс образования новых сосудов, — но при этом не всегда приводит к гибели злокачественных клеток. Подобный подход часто провоцирует гипоксию и воспаление в тканях, что, вопреки ожиданиям, может укрепить устойчивость опухоли к дальнейшему медикаментозному лечению. Новый препарат преодолевает этот недостаток, обеспечивая комбинированное воздействие по двум направлениям.
Роль ведущих научных центров в разработке
В проекте принимали участие не только ученые МГУ и Института биоорганической химии, но и коллеги из Приволжского исследовательского медицинского университета, Института прикладной физики имени А.В. Гапонова-Грехова РАН, Национального медицинского исследовательского центра радиологии Министерства здравоохранения Российской Федерации. Совместные усилия позволили интегрировать знания в области молекулярной биологии, биохимии и клинической онкологии, что сделало возможной быструю реализацию комплексной идеи.
Уникальная структура гибридного белка
В основе нового препарата лежит гибридный белок, представляющий собой модификацию природного цитокина TRAIL. Этот белок уже известен своей способностью запускать механизм гибели именно опухолевых клеток. Однако исследователи пошли дальше, дополнив структуру молекулы специальными пептидными фрагментами, способными связываться не только с белками, характерными для злокачественных клеток, но и с рецепторами на поверхности сосудов, питающих опухоль. Четырехмерное компьютерное моделирование, проведённое участниками научного коллектива, подтвердило стабильность связей всех функциональных фрагментов препарата с биологическими мишенями.
Впечатляющие результаты доклинических испытаний
Экспериментальные исследования на мышиных моделях показали, что новый препарат эффективно подавляет рост опухолей — объём новообразований сокращался примерно на 70% по сравнению с контрольной группой. Одновременно наблюдалось снижение числа сосудов внутри опухолевой ткани на 40%, что указывает на выраженный антиангиогенный эффект. Важно отметить, что ни один из компонентов гибридной молекулы не теряет своей активности при объединении, и их действие взаимно потенцируется.
Подчеркнувшие ключевую роль Российского научного фонда (РНФ) специалисты отмечают, что столь впечатляющие доклинические результаты — основа для последующих шагов к внедрению препарата в клиническую практику. По мнению экспертов, созданная комбинация может стать перспективой для терапии опухолей, устойчивых к стандартным лекарствам, а также существенно повысит эффективность существующих схем лечения.
Разработка российского коллектива — наглядный пример того, как фундаментальная наука, поддержанная междисциплинарным подходом, может быстро привести к прорывным результатам. В будущем ожидается, что испытания на других моделях и подготовка к клиническим исследованиям ускорят путь нового препарата к пациентам, открывая новые возможности лечения онкологических заболеваний. Успех этой работы подтверждает высокий потенциал российской науки и важность поддержки со стороны организаций, таких как РНФ и передовые медицинские вузы страны.
Передовые исследования в области противоопухолевых препаратов
Ученые совершили значительный прорыв в понимании того, как новый гибридный белок воздействует на самые агрессивные виды опухолевых клеток — глиобластомы и рака поджелудочной железы. В ходе лабораторных экспериментов специалисты тщательно изучили влияние препарата на культуру клеток мозга и поджелудочной железы, а также на клетки сосудов. Оказалось, что внедрение гибридного белка инициирует программируемую клеточную гибель, то есть апоптоз, в обоих типах злокачественных клеток, эффективно блокируя их дальнейший рост и деление. При этом препарат также активно подавляет размножение клеток сосудов, что затрудняет питание опухоли и способствует разрушению ее структуры.
Положительные результаты опытов на животных
Следующий этап исследований включал в себя проведение опытов на мышах. Экспериментаторы ввели под кожу животных клетки глиобластомы и рака поджелудочной железы — двух типов опухолей, отличающихся особенно агрессивным поведением и быстрым развитием. После введения комбинированной молекулы у подопытных животных наблюдалось заметное замедление роста опухолей: в группе с глиобластомой опухолевые образования сократились на 74%, а при раке поджелудочной железы — на 69%. Для сравнения, исходное соединение без пептидов показывало эффективное подавление лишь на 45% и 51% соответственно.
Особенно отрадно, что в ходе экспериментов не было выявлено побочных эффектов у подопытных мышей. Это позволяет предположить высокий профиль безопасности нового препарата, что особенно важно для будущих клинических испытаний и перспектив массового применения.
Инновационный подход к блокировке сосудистой сети опухоли
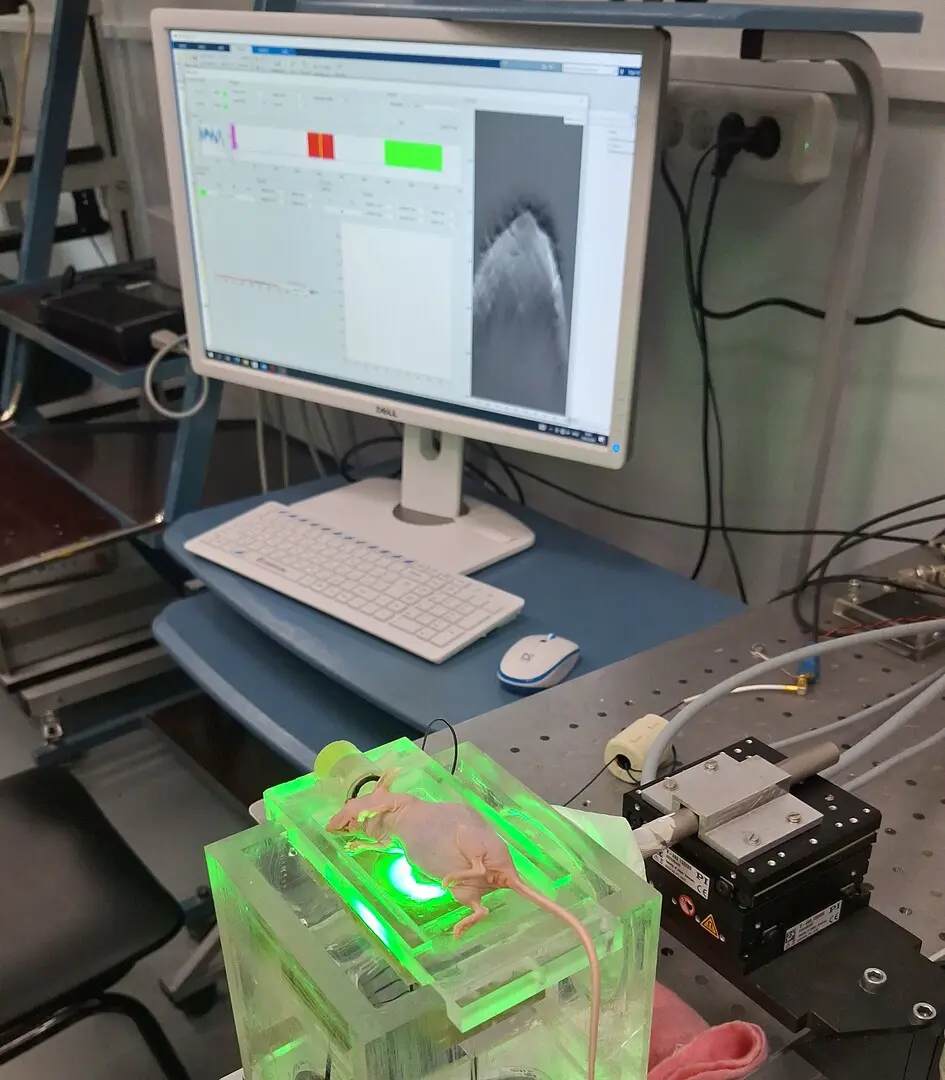
Для более детального анализа эффективности гибридного белка ученые воспользовались методом оптической ангиографии — современным инструментом визуализации сосудистой сети опухоли. Благодаря этому удалось увидеть, что применение препарата существенно снижает кровоснабжение новообразований: количество сосудов уменьшилось примерно на 40% по сравнению с контрольной группой, не проходившей лечение. Таким образом, ученые убедились, что новый белок одновременно оказывает влияние на несколько ключевых процессов — разрушает злокачественные клетки и ограничивает доступ питательных веществ к опухоли за счет уменьшения числа сосудов.
Двойной механизм действия повышает шансы препарата на успех в клинической практике и открывает новые пути в персонализированной терапии сложнейших онкологических заболеваний.
Международное сотрудничество и перспективы развития
Исследование, ставшее возможным благодаря поддержке Российского научного фонда, представляет собой результат тесного взаимодействия специалистов из ведущих научных учреждений России и Швейцарии. В работе приняли участие сотрудники Приволжского исследовательского медицинского университета, Института прикладной физики имени А.В. Гапонова-Грехова РАН, Национального медицинского исследовательского центра радиологии, Цюрихского университета и Швейцарской высшей технической школы Цюриха. Такой мультидисциплинарный подход позволил объединить лучшие научные практики различных стран и повысить качество полученных результатов.
Кандидат биологических наук Анна Яголович подчеркивает, что разработанный гибридный белок уже показал себя как многообещающее средство для борьбы с опухолями, обладающими густой сосудистой сетью. Новый препарат действует сразу на несколько мишеней, повышая эффективность лечения по сравнению с существующими аналогами. В скором времени команда планирует приступить к доклиническим испытаниям, что приблизит момент появления инновационного лекарства для борьбы с тяжелыми онкологическими заболеваниями. Оптимизм и вера в успех сопровождают исследователей на пути к созданию эффективной терапии, которая способна существенно улучшить качество жизни пациентов и дать надежду на выздоровление.
Прорыв в лечении рака: новый препарат меняет подход
В мире медицины произошёл настоящий прорыв – учёным удалось создать инновационный противоопухолевый препарат, оказывающий двойное действие. Механизм этого средства направлен не только на разрушение злокачественных клеток, но и на одновременное сокращение питания опухоли за счёт ухудшения её кровоснабжения. Такой комплексный подход означает, что раковые клетки погибают быстрее, а возможность восстановления опухоли значительно снижается.
В ходе недавних исследований было продемонстрировано, что новое средство эффективно запускает процесс гибели раковых клеток, нарушая ключевые метаболические процессы внутри опухоли. Одновременно препарат сужает сосуды, питающие опухолевую ткань, что приводит к уменьшению притока полезных веществ и кислорода. В результате злокачественные клетки теряют способность к росту и делению.
Потенциал нового подхода в практике
Первые результаты испытаний показали не только высокую эффективность препарата, но и его безопасность для организма. Пациенты отмечают хорошую переносимость, а врачи подчеркивают снижение количества побочных эффектов по сравнению с ранее применявшимися методиками. Такой подход открывает перспективы к более успешному лечению различных видов опухолей и позволяет надеяться на значительное продление жизни пациентов. Современные технологии и инновационные разработки в области медицины вселяют надежду на то, что борьба с онкологическими заболеваниями выйдет на качественно новый уровень. Новый препарат уже признан одним из самых перспективных достижений последних лет, даря шанс на выздоровление тем, кто в нём особенно нуждается.
Источник: indicator.ru